生物创新药研发新动力——纳米抗体最全制备技术分享

| 抗体
抗体是由免疫B细胞受到抗原刺激产生的能够特异性的和抗原结合的生物蛋白质分子。由于其能够高特异性,高亲和的结合抗原,抗体广泛应用在学术研究、疾病诊断以及医学药物各个方面。
| 传统抗体分子
| 重链抗体
重链抗体为驼类和软骨鱼类中天然存在的仅由两条重链组成的特殊抗体,包含一个重链可变区(VHH, Variable domain of heavy chain antibody)和两个常规的CH2与CH3区,CH1区天然缺失。重链抗体通过重链上的一个可变区(VHH)结合抗原,该可变区可以单独稳定地在体外存在,被称为驼类单域抗体(SdAb)或者纳米抗体(Nanobody)。纳米抗体晶体直径为2.5nm,长约4nm,分子量仅为传统完整抗体的1/10(约15kD)但依然具有完整的抗原识别能力。
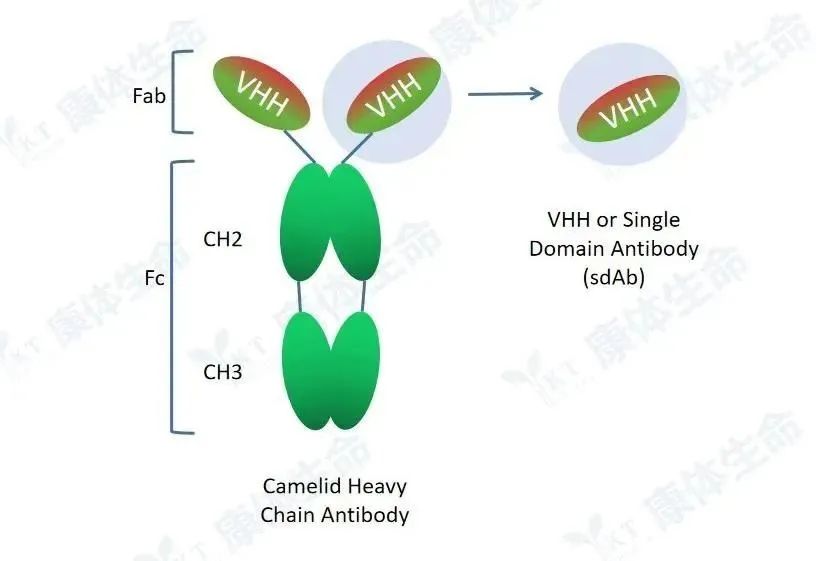
重链抗体与纳米抗体示意图
和传统抗体相比,纳米抗体分子量小,亲水性佳,并且可以通过大肠杆菌进行体外重组表达进行大量生产,有效避免传统抗体的批次间差异问题。得益于以上特征,使得纳米抗体在新药物发现方面具有一系列优势,表现出极大的潜力:
(1)可以结合传统抗体结合不到的的位点,和靶点结合特异性更强;
(2)组织穿透力更高;
(3)更高的稳定性;
(4)适合工业化大规模生产;
(5)更容易改造和优化;
(6)更容易人源化
由于纳米抗体的这些特征,越来越多的研究机构和药物生产企业在不同的场景中关注、尝试使用纳米抗体。而纳米抗体的开发不同于传统单克隆抗体通过杂交瘤制备的方法,它一般通过免疫羊驼、构建噬菌体文库和通过噬菌体展示来筛选出候选纳米抗体,再通过纳米抗体表达和纯化后进行与抗原是否结合的验证实验。
下面,我们将详细讲述筛选制备纳米抗体的流程以及其中的关键点和操作技巧,其中的每一个步骤均由深圳康体生命经过多次优化和总结,供有需要和想尝试纳米抗体筛选的机构参考。
获得单域抗体的普遍方法是羊驼经过抗原免疫后通过体内免疫系统的作用使得抗体成熟,分离羊驼外周血B淋巴细胞,提取RNA,反转录获取cDNA,以cDNA为底物PCR扩增获取多样化纳米抗体基因片段,然后将多样化纳米抗体基因片段连接到噬菌粒上,构建噬菌体库。然后通过噬菌体展示和筛选技术从羊驼抗体库中筛选得到适合的候选纳米抗体并对其进行验证。整个流程主要包括羊驼免疫、噬菌体文库构建、抗体筛选、表达纯化及验证等阶段。
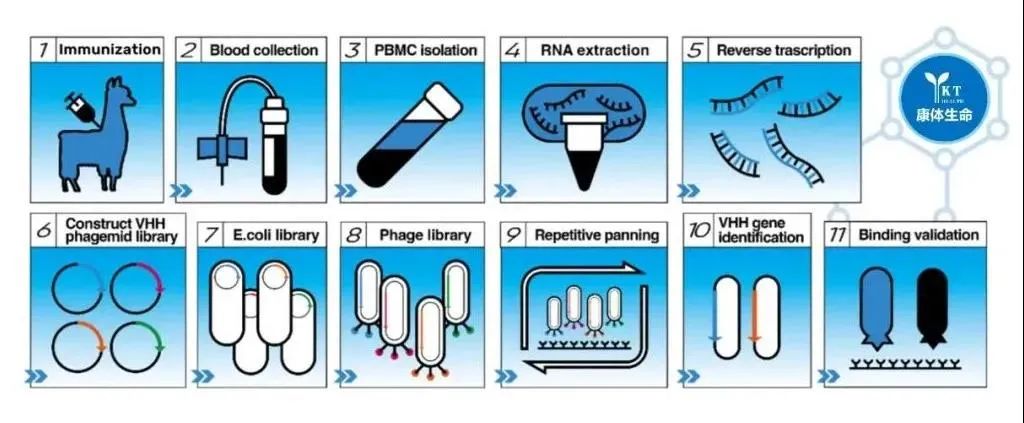
纳米抗体的制备流程图
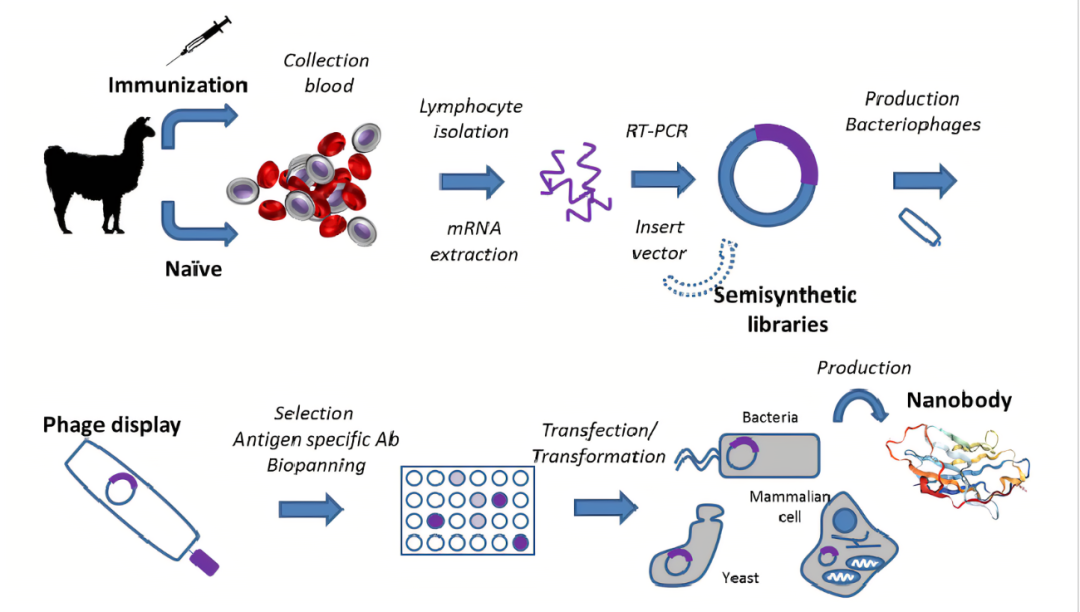
https://www.sohu.com/a/325635387_682259
1.抗原准备:一只未免适龄羊驼可以同时免疫1-3个抗原,每次免疫每种抗原剂量保持在0.5 mg左右,总体积在1.5 mL以下,免疫前将抗原和佐剂体积1:1乳化使其形成均匀混合物。
2羊驼免疫:记录空白羊驼耳号后开始免疫实验。每次在羊驼颈部淋巴结附近分左右两侧皮下注射,每侧分2点注射,每点注射约0.4mL乳化好的抗原。免疫后观察半小时确认羊驼状态良好,无不适症状。每2周免疫一次,至少进行4次免疫。
3.血清分离:每次抗原免疫前进行采血用于免疫评价,每次取5 mL血液;血液当天使用预冷25℃离心机,4000 rpm离心10分钟,分离冻存上层血清,用于后续抗体效价检测。
4.采血:在第4次免疫后间隔5-7天从羊驼颈部静脉进行采血50 mL。
5.分离淋巴细胞:在50 mL的离心管中先加入15 mL细胞分离液,然后缓慢加入15 mL血液。加入血液时小心缓慢以防止血液和分离液混匀。之后离心机预冷至25℃,400 xg离心30分钟后,观察离心管中血液分离情况,上层血清保存在新的离心管中,-80℃保存,用移液器小心吸取出中间棉状上层免疫细胞至新的50 mL离心管中。每管加入室温放置的10 mL PBS缓冲液,25℃,400 xg离心20分钟。去除上清液,每管加入室温放置的5 mL PBS缓冲液,轻轻混匀后,使用血球计数板计算细胞数目,然后25℃,400 xg离心20分钟。去除上清液,根据细胞数目使用RNAiso Plus溶解分离得到的淋巴细胞得到107/mL细胞溶解液,-80℃保存。
1.羊驼的选择和选择合适的抗原是免疫成功的关键。选择健康强壮、精神状态良好、体型适中的未免羊驼即空白羊驼。免疫抗原的纯度以及其正确构象对免疫羊驼后筛选到合适的抗体以及后续应用至关重要,蛋白抗原纯度一般至少不低于90%。
2.淋巴细胞的分离:及时的细胞分离可以有效阻止血液采集后的溶血以达到最好的分离效果。
3.免疫周期的选择可影响免疫效果,根据经验,1-2周免疫间隔可以使羊驼对大部分抗原有良好的免疫反应。

羊驼免疫及采血图
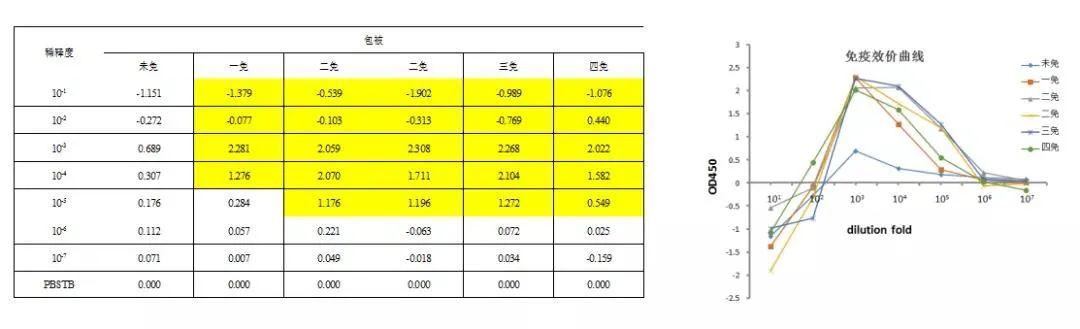
免疫效果检测图
1.RNA提取:将用Trizol保存的外周血淋巴细胞冰上溶解后转移至1.5 mL的离心管,加入1/5体积的氯仿震荡混匀;室温静置5分钟后4℃,12000g离心15分钟;将离心后的上清液转移到新的离心管;往新离心管中加入等体积的异丙醇;颠倒混匀室温静置10分钟后4℃ 12000g离心10分钟;弃上清后用75%乙醇清洗沉淀,4℃ 7500g 离心5分钟后弃去上清,沉淀室温晾干后溶解于适量的无RNA酶的水中。
2.反转录获取cDNA:按照反转录试剂盒说明书将上一步得到的RNA一分为二反转录成cDNA,反转录引物分别用Oligo dT及random primers。
3.抗体片段扩增:从反转录的cDNA中扩增特定的抗体片段,使用Taq DNA Polymerase Hot Start酶进行PCR扩增。PCR反应体系为:cDNA模板 2 µL,Alpa001F引物2 µL,Alpa001R引物 2 µL,10x Taq Buffer 5 µL,dNTP 4 µL, Taq(HS) 0.25 µL,ddH2O补足到50 µL。PCR的反应条件为:98℃ 3分钟;95℃ 30秒,57℃30秒,72℃ 40秒,每个循环增加2秒,重复22个循环;72℃ 5分钟。将得到的PCR扩增产物进行1%琼脂糖凝胶电泳,可以看到一条1.0kb 左右一条0.7kb 左右的PCR条带,对0.7 kb大小的条带切胶使用DNA纯化回收试剂盒按说明书进行回收。以上一步PCR扩增并回收后的DNA片段作为模板再次扩增特定的抗体片段,使用Taq DNA Polymerase Hot Start Version酶进行PCR扩增。PCR反应体系为:DNA模板 2 ul,Alpa002F引物 2 µL,Alpa002R引物 2 µL,10x Taq Buffer 5 µL, dNTP 4 µL, Taq(HS) 0.25 µL, ddH2O补足到50 µL。PCR的反应条件为:98℃ 3分钟;95℃ 50秒,55℃30秒,72℃ 40秒,重复12个循环;72℃10分钟。将得到的PCR扩增产物使用DNA纯化回收试剂盒按说明书回收。
4.克隆至噬菌体质粒:将上一步扩增得到的多样化抗体基因序列和噬菌体载体进行酶切,各自纯化并进行链接反应。将连接产物使用DNA纯化回收试剂盒按说明书回收,并使用超纯水溶解。
5.转化TG1:提前将无菌的电转杯置于冰上预冷,待TG1感受态细胞50 µL融化后加入100 ng回收后的连接产物,将混合后的感受态细胞和连接产物转移到预冷好的电转杯中,使用电转仪预设的Bacteria转化程序电击转化,电转后立即往电转杯中加入1 mL SOC培养基,至少进行20个电转,将细胞37℃复苏60分钟后涂在含有氨苄抗性的LB培养板上过夜生长。将上一步过夜生长后的培养板上的细胞用2xYT培养基和涂布棒冲洗刮下,加入20%的甘油测OD600nm值后保存在-80℃,即为菌库。
6.扩增和纯化噬菌体文库:将上一步刮下的菌体混匀后将数目约为10^9个细菌转移到100 mL预先加入氨苄抗生素的2x YT培养液中,37℃ 220 rpm培养直至OD600nm达到0.5。按照辅助噬菌体:细菌细胞数目为20:1的比例加入辅助噬菌体后继续37℃培养30分钟。加入终浓度为50 µg/mL的卡那霉素,30℃过夜摇床培养。将过夜培养的细菌4℃ 13000 rpm离心5分钟,将上清转移到新的离心管后加入1/4体积预冷的 5x PEG8000/NaCl,在冰上孵育30-60分钟。4℃ 13000 rpm离心10分钟去除上清后加入1 mL PBS缓冲液溶解沉淀。再次加入250 µL 5X PEG8000/NaCl 后冰上孵育10分钟,4℃ 16000 xg离心15分钟后去除上清并将沉淀溶解在1 mL PBS中得到噬菌体库,长期-80℃保存,短期(1-2周)可于-20℃放置保存。
1.噬菌体文库的库容量和多样性是衡量文库质量的重要标准之一,容量越大、多样性越好的库是成功筛选出纳米抗体的有效保证;
2.影响文库容量和多样性的关键点包括:提取RNA过程中RNA的降解、反转录过程中的模板和引物、扩增过程中引物的选择和模板的用量以及PCR扩增轮数、感受态细菌的转化效率、连接体系的大小等因素。

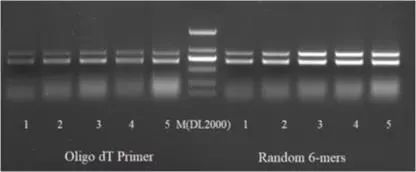
第一轮PCR
1.包被免疫管:将50 µg 抗原加入到2 mL PBS中并加入到免疫管中,4℃缓慢旋转过夜孵育。
2.封闭:将适量扩增和纯化的噬菌体 加入到1 mL 3% BSA中,室温旋转孵育2小时。同时往包被好的免疫管中加入2-3 mL 3% BSA,室温旋转孵育2小时。
3.抗原和噬菌体孵育:将封闭后的免疫管用含有0.01%吐温的PBS洗3次,每次5分钟。将封闭后的噬菌体文库加入到封闭后的免疫管中,添加PBS直至2-3 mL,室温旋转孵育1小时。
4.清洗:将抗原和噬菌体孵育后的免疫管用含有0.1%吐温的PBS洗20次,每次5分钟。
5.洗脱:将免疫管内液体弃掉,尽量去除残余液体,加入1 mL 0.25 mg/mL Trypsin溶液,室温旋转洗脱30分钟,加入10 µL 10%AEBSF终止洗脱,将免疫管中的溶液转移至新的1.5 mL离心管中,即为第一轮筛选噬菌体洗脱液。
6.噬菌体洗脱液效价检测:取第一轮噬菌体洗脱液10 µL,在1.5 mL离心管中10倍梯度稀释,共稀释10个梯度,在每个稀释离心管中加入90 µL OD600为0.5-0.55的TG1菌液,混匀后37℃孵育30分钟,将各个梯度的菌液涂布到2×YT固体培养基(Amp)中,37℃倒置过夜培养,第二天统计培养板上的单菌落个数并计算噬菌体洗脱液效价;
7.第一轮噬菌体洗脱液的扩增:取500µl第一轮筛选后得到的噬菌体洗脱液至5 mL OD600为0.5-0.55的菌液中,37℃,250 rpm继续培养30分钟,将全部菌液均匀涂布到含有100 µg/mL Amp和2%葡萄糖的2%琼脂糖的固体培养板中,37℃过夜培养。第二天将培养板的菌落刮下来收集至离心管中,即为扩增后的细菌子文库。按照噬菌体文库扩增和纯化方法,再重复筛选过程2次,逐次减半包被免疫管的抗原量,得到3次筛选后的洗脱噬菌体。洗脱的噬菌体可进行NGS测序,得到与抗原结合的候选纳米抗体DNA序列库。
8.ELISA鉴定:
8.1 将最后一轮筛选得到的噬菌体梯度稀释后,各取10 µL加入到OD600nm为0.5的TG1菌液中,37℃培养30分钟后涂布含有氨苄霉素的2x YT培养板上,37℃过夜培养第二天得到单克隆菌落;
8.2 随机挑选至少192个单菌落到含有氨苄霉素的2x YT培养液的96孔细胞培养板上,37℃过夜培养后作为种子菌板,重新取菌液2 µL 加入新的96孔板(每孔含200 µL 2x YT新鲜培养液,100 µg/mL 氨苄),37℃培养5小时后,往培养孔中加入辅助噬菌体(每孔加入辅助噬菌体M13K07以使细菌个数:噬菌体数=1:20),37℃静置30分钟后加入终浓度为50 µg/mL的卡纳霉素,30℃过夜培养。第二天将过夜培养后的菌液离心,获得含噬菌体的上清液,4℃保存备用;
8.3 将筛选抗原包被酶标板(1 ng/µL,包被液为pH9.4的CBS,100 µL /孔),同时平行包被BSA作对照,4°C包被过夜;将过夜包被的酶标板内液体弃掉,每孔加入200 µL PBS缓冲液,室温清洗酶标板3次,每次10分钟;每孔加入200 µL封闭液(3% BSA)封闭酶标板,室温封闭1小时;
8.4 弃封闭液,每孔加入200 µL PBST(1×PBS加0.1% Tween20,下同)缓冲液,室温清洗酶标板3次,每次10分钟;
8.5 每孔加入120 µL 3% BSA后再加入80 µL步骤8.2离心后得到的噬菌体上清液,室温孵育2小时;弃掉酶标板内液体,每孔加入200 µL PBST缓冲液洗涤3次,每次10分钟;
8.6 每孔加入M13 Bacteriophage Antibody(HRP),Mouse Mab,0.1 ng/µL稀释于封闭液中,100 µL /孔,室温孵育1小时;
8.7 弃掉ELISA板内液体,每孔加入200 µl PBST缓冲液洗涤3次,每次10分钟;
8.8 每孔加入100 µL TMB单组份显色液,避光显色2-3 分钟,每孔加入100 µL 1M Hcl终止,用酶标仪读取OD450值,记录并保存;
选取抗原包被孔与相应对照孔吸光值比例大的菌落送去测序(独立两次phage-Elisa分析),得到候选纳米抗体的基因序列。
1.合适量的抗原包被和抗原的分子量大小、疏水亲水性质、结构有关,也和包被缓冲液和包被介质的选择有关,合理的包被是成功筛选的基础,如果有必要可以进行预实验确定包被的条件或者可选择抗原结合磁珠的方法进行筛选。
2.洗脱后测定噬菌体的效价,经过2-4轮抗原包被淘选后,噬菌体的富集程度需要在合理范围之内。
噬菌体洗脱液效价检测
 ` 免疫效果检测图
` 免疫效果检测图
Phage-Elisa筛选出的单克隆菌株进行纳米抗体片段DNA测序后即可进行表达纯化及验证。
纳米抗体可在大肠杆菌,酵母或哺乳动物细胞系里进行表达,因其仅含100多个氨基酸残基,为验证其是否与抗原结合,可构建质粒在大肠杆菌中或酵母菌株中进行快速表达及纯化,或者同时在两种菌株中进行表达纯化。
大厂杆菌中纳米抗体
的诱导表达及纯化
质粒构建序列确认后转化表达菌株,如BL21,挑取单菌落进行摇瓶培养后IPTG诱导表达,菌体破碎后将上清液中可溶蛋白进行纯化,包括亲和层析,离子交换层析及分子筛层析等方法。
毕赤酵母中纳米抗体
的表达及纯化
质粒构建序列确认后及酶切线性化后将线性化质粒电转进酵母如GS115或X33菌株中,平板上筛选确认单菌落后甲醇诱导表达,分泌至胞外,发酵液上清中的纳米抗体可直接Elisa验证,阳性序列进行纯化。
大肠杆菌表达的优点是可迅速诱导表达,缺点是部分纳米抗体可形成包涵体,其胞内还原环境不利于纳米抗体中二硫键的形成,毕赤酵母表达的优点是可利用毕赤酵母对蛋白进行胞外分泌,从而不用进行菌体破碎,而直接从酵母发酵上清液中进行纳米抗体纯化,并且酵母很少分泌杂蛋白至胞外使得发酵上清液中的纳米抗体纯度相对较高从而易于纯化,并且胞外的氧化环境有利于纳米抗体二硫键的形成,纳米抗体中二硫键的形成对纳米抗体的稳定性至关重要。
候选纳米抗体纯化后可验证
其余抗原是否结合及与抗原
结合的亲和力检测
SPR实验利用的机型为BiacoreT200,具体操作流程详见《BiacoreT200检测蛋白与蛋白结合操作指南》。
纳米抗体的规模表达纯化
因纳米抗体为分子量约15KD左右的单链蛋白,其可由大肠杆菌或酵母中进行诱导表达并在发酵罐中规模表达,其产量均在g/L以上,故可进行量产应用于试剂盒检测,甚至临床药物规模化量产。







